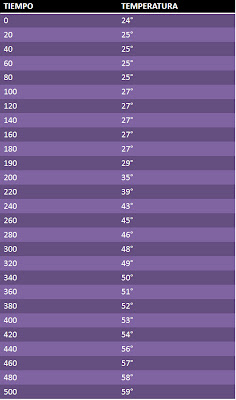
Objetivo:Separar una mezcla solida mediante cristalizacion
Antecedentes: CRISTALIZACION
Hipotesis: Obtener los componentes solidos de la mezcla utilizando la cristalizacion.
Material: Embudo , vaso precipitado , pinzas , agitador , base universal , mechero fisher , asbesto , sal , azucar , papel filtro , agua.
Procedimiento : Disuelve el azucar y sal en agua.
Poner a calentar.
Separar los cristales aobtenidos por el cambio de temperatura .
Enfriar aun mas para obtener ultimos cristales.
Conclusion: No terminamos la separacion asi que no existe conclusion.
domingo, 28 de agosto de 2011
PRACTICA 3
Objetivo: Separar una mezcla homogenea liquida mediante la ebullicion.
Antecedentes:DESTILACION
Material: Crsitalizador , pinzas para crizol , vaso precipitado , quitasato , cristalizadro , matraz , mechero , manguera de latex , bandeja , cerillos , agua , acetona.
Hipotesis : Separar la mezcla por medio del punto de ebullicion , esto es para la separacion de liquidos.
Procedimiento:Colocar base universal en el punto , en esta coloca el asbesto (sobre ella coloca el cristalizador con agua).
Colocar mezcla en el quitasato y posteriormente colocarlo en el cristalizador.
Tapar el quitasato y el termometro.
Agarrar el quitasato con las pinzas de 3 dedos .
Llenar la bandeja con agua y pasar dentro de ella la maguera de latex del quitasato.
Al final de ella poner un vaso precipitado.
Conectar el mechero fisher a la llave de gas y colocarlo de bajo del cristalizador.
Antecedentes:DESTILACION
Material: Crsitalizador , pinzas para crizol , vaso precipitado , quitasato , cristalizadro , matraz , mechero , manguera de latex , bandeja , cerillos , agua , acetona.
Hipotesis : Separar la mezcla por medio del punto de ebullicion , esto es para la separacion de liquidos.
Procedimiento:Colocar base universal en el punto , en esta coloca el asbesto (sobre ella coloca el cristalizador con agua).
Colocar mezcla en el quitasato y posteriormente colocarlo en el cristalizador.
Tapar el quitasato y el termometro.
Agarrar el quitasato con las pinzas de 3 dedos .
Llenar la bandeja con agua y pasar dentro de ella la maguera de latex del quitasato.
Al final de ella poner un vaso precipitado.
Conectar el mechero fisher a la llave de gas y colocarlo de bajo del cristalizador.
| Conclusiones: Se destilo exitosamente por el medio de destilacion de acuerdo a sus puntos de ebullicion de cada sustancia. |
PRACTICA 2
Mezcla 2: Separar una mezcla heterogenea , 1 fase solida y una liquida.
Hipotesis: Se espera que al colocar la mezcla en el recipiente de ceramica y al subir la temperatura las particulas del liquido adquiran mayor energia haciendo asi que se evapore y se distinga la fase solida .
Procedimineto: Colocar la reja de albesto y el mechero de polsen sobre la base universal.
Vasear una pequeña cantidad sobre el recipiente de ceramica y (colocarlo sobre la reja de asbesto).
Prender el fuego , conectar la manguera del tubo latex (por aqui saldra gas) y acerca cuidadosamente un cerillo y busca la llama mas azul.
Esperar a que caliente para lograr la evaporacion.
Conclusion:El liquido se evaporo dejando solamente al solido asi logrando la separacion.
Observaciones: Se tiene la mezcla de un solido y un liquido , el solido es mas denso que el liquido.
Hipotesis: Se espera que al colocar la mezcla en el recipiente de ceramica y al subir la temperatura las particulas del liquido adquiran mayor energia haciendo asi que se evapore y se distinga la fase solida .
Procedimineto: Colocar la reja de albesto y el mechero de polsen sobre la base universal.
Vasear una pequeña cantidad sobre el recipiente de ceramica y (colocarlo sobre la reja de asbesto).
Prender el fuego , conectar la manguera del tubo latex (por aqui saldra gas) y acerca cuidadosamente un cerillo y busca la llama mas azul.
Esperar a que caliente para lograr la evaporacion.
Conclusion:El liquido se evaporo dejando solamente al solido asi logrando la separacion.
Observaciones: Se tiene la mezcla de un solido y un liquido , el solido es mas denso que el liquido.
PRACTICA 1
Mezcla 1 : Separar una mezcla heterogena 2 fases liquida y solida.
Hipotesis. Separar la mezcla heterogenea mediante el uso de 2 metodos (filtracion y decantacion)
Observaciones: En esta mezcla se observa 2 fases liquidas (incoloros inmiscibles) y una solida (son menos densos que los liquidos).
Procedimiento:Doblar el papel filtro formando una base conica y colocarlo en el embudo.(humedece el embudo)
Vaciar dentro del embudo y el filtro el liquido menos denso y el solido.
Retirar el papel filtro del embudo(en el filtro permanecera el elemento solido de la mezcla
Ahora que separaste el liquido denso vuelvelo a mezclar con el liquido mas denso para su posterior separacion.
Poner el embudo de decantacion en la base universal parea la separacion de los liquidos .
Introducir la mezcla en el embudo y esperar a que se asiente el elemento mas denso.
Abrir la llave del embudo cuidadosamente hasta que el liquido mas denso caiga.
Cambiar el vaso para recibir la otra sustancia.
Conclusion: Los 3 componentes fueron separados exitosamente mediante los procesos antes mencionados.
Hipotesis. Separar la mezcla heterogenea mediante el uso de 2 metodos (filtracion y decantacion)
Observaciones: En esta mezcla se observa 2 fases liquidas (incoloros inmiscibles) y una solida (son menos densos que los liquidos).
Procedimiento:Doblar el papel filtro formando una base conica y colocarlo en el embudo.(humedece el embudo)
Vaciar dentro del embudo y el filtro el liquido menos denso y el solido.
Retirar el papel filtro del embudo(en el filtro permanecera el elemento solido de la mezcla
Ahora que separaste el liquido denso vuelvelo a mezclar con el liquido mas denso para su posterior separacion.
Poner el embudo de decantacion en la base universal parea la separacion de los liquidos .
Introducir la mezcla en el embudo y esperar a que se asiente el elemento mas denso.
Abrir la llave del embudo cuidadosamente hasta que el liquido mas denso caiga.
Cambiar el vaso para recibir la otra sustancia.
Conclusion: Los 3 componentes fueron separados exitosamente mediante los procesos antes mencionados.
martes, 23 de agosto de 2011
Metodos de separacion
EVAPORACION
Consiste en calentar la mezcla hasta el punto de ebullición de uno de los componentes, y dejarlo hervir hasta que se evapore totalmente. Este método se emplea si no tenemos interes en utilizar el componente evaporado. Los otros componentes quedan en el envase.

FILTRACION
Se fundamenta en que alguno de los componentes de la mezcla no es soluble en el otro, se encuentra uno sólido y otro líquido. Se hace pasar la mezcla a través de una placa porosa o un papel de filtro, el sólido se quedará en la superficie y el otro componente pasará.
Se pueden separar sólidos de partículas sumamente pequeñas, utilizando papeles con el tamaño de los poros adecuados.

DESTILACION
La destilación es el prcedimiento más utilizado para la separación y purificación de líquidos, y es el que se utiliza siempre que se pretende separar un líquido de sus impurezas no volátiles.
La destilación, comoproceso, consta de dos fases: en la primera, el líquido pasa a vapor y en la segunda el vapor se condensa, pasando de nuevo a líquido en un matraz distinto al de destilación.

DECANTACION
La decantación (del latin decantatĭo, -ōnis[1] ) es un método físico de separación de mezclas heterogeneas, estas pueden ser formadas por un liquido y un solido, o por dos líquidos. Es necesario dejarla reposar para que el sólido sesedimente, es decir, descienda y sea posible su extracción por acción de lagravedad. A este proceso se le llama desintegración básica de los compuestos o impurezas; las cuales son componentes que se encuentran dentro de una mezcla, en una cantidad mayoritaria.

CRISTALIZACION
La cristalización es el proceso por el cual se forma un solido cristalino, ya sea a partir de un gass, un líquido o una disolución. La cristalización es un proceso en donde los iones, átomos o moléculas que constituyen la red cristalina crean enlaces hasta formar cristales, que se emplea en química con bastante frecuencia para purificar una sustancia sólida. La operación de cristalización es aquella por medio de la cual se separa un componente de una solución liquida transfiriéndolo a la fase sólida en forma de cristales que precipitan. Es una operación necesaria para todo producto químico que se presenta comercialmente en forma de polvos o cristales, ya sea el azúcar o sacarosa, la sal común o cloruro de sodio.
Si se prepara una disolución concentrada a alta temperatura y se enfría, se forma una disolución sobresaturada, que es aquella que tiene, momentáneamente, más soluto disuelto que el admisible por la disolución a esa temperatura en condiciones de equilibrio. Posteriormente, se puede conseguir que la disolución cristalice mediante un enfriamiento controlado. Esencialmente cristaliza el compuesto principal, y las aguas madre se enriquecen con las impurezas presentes en la mezcla inicial al no alcanzar su límite de solubilidad.Para que se pueda emplear este método de purificación debe haber una variación importante de la solubilidad con la temperatura, lo que no siempre es el caso. La sal marina (NaCl), por ejemplo, tiene una solubilidad de unos 35 g /100 ml en el intervalo de temperaturas comprendido entre 0 y 100 °C, lo que hace que la cristalización por cambio de temperatura sea poco importante, no así en otras sales, como KNO3. Cuanto mayor sea la diferencia de solubilidad con la temperatura, se pueden obtener mayores rendimientos. A escala industrial, estas operaciones pueden además incluir procesos de purificación complementarios como el filtrado, la decantación de impurezas, etc. Luego de hacer este procedimiento el material queda totalmente puro
El método de purificación debe hacer una variación de la solubilidad con la temperatura lo que siempre es el caso.

lunes, 22 de agosto de 2011
CROMATOGRAFIA
CROMATOGRAFIA
La cromatografía es un método físico de separación para la caracterización de mezclas complejas, la cual tiene aplicación en todas las ramas de la ciencia y la física. Es un conjunto de técnicas basadas en el principio de retención selectiva, cuyo objetivo es separar los distintos componentes de una mezcla, permitiendo identificar y determinar las cantidades de dichos componentes.
Las técnicas cromatográficas1 son muy variadas, pero en todas ellas hay una fase móvil que consiste en un fluido (gas, líquido o fluido supercrítico) que arrastra a la muestra a través de una fase estacionaria que se trata de un sólido o un líquido fijado en un sólido. Los componentes de la mezcla interaccionan en distinta forma con la fase estacionaria. De este modo, los componentes atraviesan la fase estacionaria a distintas velocidades y se van separando. Después de que los componentes hayan pasado por la fase estacionaria, separándose, pasan por un detector que genera una señal que puede depender de la concentración y del tipo de compuesto.
Diferencias sutiles en el coeficiente de partición de los compuestos da como resultado una retención diferencial sobre la fase estacionaria y por tanto una separación efectiva en función de los tiempos de retención de cada componente de la mezcla.
La cromatografía puede cumplir dos funciones básicas que no se excluyen mutuamente:
§ Separar los componentes de la mezcla, para obtenerlos más puros y que puedan ser usados posteriormente (etapa final de muchas síntesis).
§ Medir la proporción de los componentes de la mezcla (finalidad analítica). En este caso, las cantidades de material empleadas son pequeñas.
Las distintas técnicas cromatográficas se pueden dividir según cómo esté dispuesta la fase estacionaria:
§ Cromatografía plana. La fase estacionaria se sitúa sobre una placa plana o sobre un papel. Las principales técnicas son:
§ Cromatografía en columna. La fase estacionaria se sitúa dentro de una columna. Según el fluido empleado como fase móvil se distinguen:
La cromatografía de gases es útil para gases o para compuestos relativamente volátiles, lo que incluye a numerosos compuestos orgánicos. En el caso de compuestos no volátiles se recurre a procesos denominados de "derivatización", a fin de convertirlos en otros compuestos que se volatilizen en las condiciones de análisis.
Dentro de la cromatografía líquida destaca la cromatografía líquida de alta resolución (HPLC, del inglés High Performance Liquid Chromatography), que es la técnica cromatográfica más empleada en la actualidad, normalmente en su modalidad de fase reversa, en la que la fase estacionaria tiene carácter no polar, y la fase móvil posee carácter polar (generalmente agua o mezclas con elevada proporción de la misma, o de otros disolvente polares, como por ejemplo metanol). El nombre de "reversa" viene dado porque tradicionalmente la fase estacionaria estaba compuesta de sílice o alúmina, de carácter polar, y por tanto la fase móvil era un disolvente orgánico poco polar. Una serie eluotrópica, es un rango de sustancias de diferentes polaridades que actúan como fase móvil y que permiten observar un mejor desplazamiento sobre una fase estacionaria.
HISTORIA
A comienzos del año 1903, Mijail Tsvet usó columnas de adsorción de líquidos para separar pigmentos vegetales (por ejemplo,clorofilas). Las disoluciones se hacían pasar a través de una columna de vidrio rellena de carbonato de calcio, que finamente dividido de un material poroso que interacciona de forma diferente con los componentes de la mezcla, de forma que éstos se separaban en distintas bandas coloreadas a lo largo de la columna.
Los primeros equipos de cromatografía de gases aparecieron en el mercado a mediados del siglo XX. A su vez, la cromatografía líquida de alta resolución (HPLC) comenzó a desarrollarse en los años 1960, aumentando su importancia en las décadas siguientes, hasta convertirse en la técnica cromatográfica más empleada. Sin embargo esto se irá modificando con el paso de los años.
PROCESO
§ Fase móvil es la fase que se mueve en una dirección definida. Puede ser un líquido (cromatografía de líquidos o CEC). un gas (cromatografía de gases) o un fluido supercrítico (cromatografía de fluidos supercríticos). La fase móvil consiste en la muestra que está siendo separada/analizada y el disolvente, que se mueven por el interior de la columna. En el caso de la cromatografía líquida de alta resolución, HPLC, la fase móvil es un disolvente no-polar como el hexano (fase normal) o bien algún disolvente polar (cromatografía de fase reversa) y la muestra que va a ser separada.. La fase móvil se mueve a través de la columna de cromatografía (fase estacionaria) de forma que la muestra interacciona con la fase estacionaria y se separa.
§ Cromatografía preparativa se usa para purificar suficiente cantidad de sustancia para un uso posterior, más que para análisis.
§ Tiempo de retención es el tiempo característico que tarda un analito particular en pasar a través del sistema (desde la columna de entrada hasta el detector) bajo las condiciones fijadas. Véase también: Índice de retención de Kovats
§ Muestra es la materia que va a ser analizada en la cromatografía. Puede consistir en un simple componente o una mezcla de varios. Cuando la mezcla es tratada en el curso del análisis, la fase o fases que contienen los analitos de interés es llamada igualmente muestra mientras el resto de sustancias cuya separación no resulta de interés es llamada residuo.
§ Soluto es cada uno de los componentes de la muestra que va a ser separado.
§ Disolvente es toda sustancia capaz de solubilizar a otra,y especialmente la fase líquidamóvil en cromatografía de líquidos.
§ Fase estacionaria es la sustancia que está fija en una posición en el procedimiento de la cromatografía. Un ejemplo es la capa de silica en la cromatografía en capa fina.
martes, 16 de agosto de 2011
DIFERENCIAS DE MEZCLAS , COMPUESTOS , ELEMENTOS.
SUSTANCIA PURA materia de composición química definida se compone por elementos y compuestos
ELEMENTO sustancia simple que no puede descomponerse en otra más simple, Los nombres de los elementos se representan mediante símbolos. Existen dos reglas para escribir un símbolo correctamente:
• Si el símbolo es una sola letra, ésta debe ser mayúscula.
• Si el símbolo tiene dos o tres letras la primera es mayúscula y las demás son minúsculas.
COMPUESTO unión quimica de 2 o mas elementos diferentes esta se puede descomponer por medios químicos en dos o más sustancias diferentes .Al unirse se crea masa fija y definida
MEZCLA. Elementos se unen de manera que forman una sustancia íntegramente unida y generalmente diferente a las características de los elementos que la componen , Las mezclas están formados por dos o más sustancias puras (elementos y/o compuestos), Estos solo se separan por métodos físicos y sus componentes no pierden propiedad. Esta se divide en 2 grupos:
• Mezclas homogéneas.-tiene composición química uniforme en toda su composición , esta formada por 2 o mas sustancias con apariencia física uniforme , al mezclarse se les nombra a sus componentes como soluto y soluble.
• Mezclas heterogéneas.-Su composición es variable , esta formado por 2 o mas sustancias donde cada una conserva su apariencia física y se distinguen
REDACCION
Respecto con el video es una fuente muy buena pues te hace comprender mucho mejor las características de sustancias puras que las componen , que es un elemento de que esta compuesto , que es un compuesto que lo integra , que es una mezcla cuales son sus funciones como se forma , etc.
Aparte te menciona que antes de todo todo esta formado por la materia y esta se clasifica en sustancias puras y mezclas en base a estos los seres vivos , objetos , etc. somos diferentes .
Los elementos están formados por átomos que están en forma liquida, solida o gaseosa.
Los átomos de un elemento o mezcla se pueden formar por medio de formulas.
Podemos observar como en la vida cotidiana tenemos el caso de mezclas heterogéneas y homogéneas, como los seres vivos , los animales al clasificarlos.
IMAGENES
ELEMENTO sustancia simple que no puede descomponerse en otra más simple, Los nombres de los elementos se representan mediante símbolos. Existen dos reglas para escribir un símbolo correctamente:
• Si el símbolo es una sola letra, ésta debe ser mayúscula.
• Si el símbolo tiene dos o tres letras la primera es mayúscula y las demás son minúsculas.
COMPUESTO unión quimica de 2 o mas elementos diferentes esta se puede descomponer por medios químicos en dos o más sustancias diferentes .Al unirse se crea masa fija y definida
MEZCLA. Elementos se unen de manera que forman una sustancia íntegramente unida y generalmente diferente a las características de los elementos que la componen , Las mezclas están formados por dos o más sustancias puras (elementos y/o compuestos), Estos solo se separan por métodos físicos y sus componentes no pierden propiedad. Esta se divide en 2 grupos:
• Mezclas homogéneas.-tiene composición química uniforme en toda su composición , esta formada por 2 o mas sustancias con apariencia física uniforme , al mezclarse se les nombra a sus componentes como soluto y soluble.
• Mezclas heterogéneas.-Su composición es variable , esta formado por 2 o mas sustancias donde cada una conserva su apariencia física y se distinguen
REDACCION
Respecto con el video es una fuente muy buena pues te hace comprender mucho mejor las características de sustancias puras que las componen , que es un elemento de que esta compuesto , que es un compuesto que lo integra , que es una mezcla cuales son sus funciones como se forma , etc.
Aparte te menciona que antes de todo todo esta formado por la materia y esta se clasifica en sustancias puras y mezclas en base a estos los seres vivos , objetos , etc. somos diferentes .
Los elementos están formados por átomos que están en forma liquida, solida o gaseosa.
Los átomos de un elemento o mezcla se pueden formar por medio de formulas.
Podemos observar como en la vida cotidiana tenemos el caso de mezclas heterogéneas y homogéneas, como los seres vivos , los animales al clasificarlos.
IMAGENES
DIFERENCIAS DE MEZCLAS , COMPUESTOS , ELEMENTOS.
SUSTANCIA PURA materia de composición química definida se compone por elementos y compuestos
ELEMENTO sustancia simple que no puede descomponerse en otra más simple, Los nombres de los elementos se representan mediante símbolos. Existen dos reglas para escribir un símbolo correctamente:
• Si el símbolo es una sola letra, ésta debe ser mayúscula.
• Si el símbolo tiene dos o tres letras la primera es mayúscula y las demás son minúsculas.
COMPUESTO unión quimica de 2 o mas elementos diferentes esta se puede descomponer por medios químicos en dos o más sustancias diferentes .Al unirse se crea masa fija y definida
MEZCLA. Elementos se unen de manera que forman una sustancia íntegramente unida y generalmente diferente a las características de los elementos que la componen , Las mezclas están formados por dos o más sustancias puras (elementos y/o compuestos), Estos solo se separan por métodos físicos y sus componentes no pierden propiedad. Esta se divide en 2 grupos:
• Mezclas homogéneas.-tiene composición química uniforme en toda su composición , esta formada por 2 o mas sustancias con apariencia física uniforme , al mezclarse se les nombra a sus componentes como soluto y soluble.
• Mezclas heterogéneas.-Su composición es variable , esta formado por 2 o mas sustancias donde cada una conserva su apariencia física y se distinguen
REDACCION
Respecto con el video es una fuente muy buena pues te hace comprender mucho mejor las características de sustancias puras que las componen , que es un elemento de que esta compuesto , que es un compuesto que lo integra , que es una mezcla cuales son sus funciones como se forma , etc.
Aparte te menciona que antes de todo todo esta formado por la materia y esta se clasifica en sustancias puras y mezclas en base a estos los seres vivos , objetos , etc. somos diferentes .
Los elementos están formados por átomos que están en forma liquida, solida o gaseosa.
Los átomos de un elemento o mezcla se pueden formar por medio de formulas.
Podemos observar como en la vida cotidiana tenemos el caso de mezclas heterogéneas y homogéneas, como los seres vivos , los animales al clasificarlos.
IMAGENES
ELEMENTO sustancia simple que no puede descomponerse en otra más simple, Los nombres de los elementos se representan mediante símbolos. Existen dos reglas para escribir un símbolo correctamente:
• Si el símbolo es una sola letra, ésta debe ser mayúscula.
• Si el símbolo tiene dos o tres letras la primera es mayúscula y las demás son minúsculas.
COMPUESTO unión quimica de 2 o mas elementos diferentes esta se puede descomponer por medios químicos en dos o más sustancias diferentes .Al unirse se crea masa fija y definida
MEZCLA. Elementos se unen de manera que forman una sustancia íntegramente unida y generalmente diferente a las características de los elementos que la componen , Las mezclas están formados por dos o más sustancias puras (elementos y/o compuestos), Estos solo se separan por métodos físicos y sus componentes no pierden propiedad. Esta se divide en 2 grupos:
• Mezclas homogéneas.-tiene composición química uniforme en toda su composición , esta formada por 2 o mas sustancias con apariencia física uniforme , al mezclarse se les nombra a sus componentes como soluto y soluble.
• Mezclas heterogéneas.-Su composición es variable , esta formado por 2 o mas sustancias donde cada una conserva su apariencia física y se distinguen
REDACCION
Respecto con el video es una fuente muy buena pues te hace comprender mucho mejor las características de sustancias puras que las componen , que es un elemento de que esta compuesto , que es un compuesto que lo integra , que es una mezcla cuales son sus funciones como se forma , etc.
Aparte te menciona que antes de todo todo esta formado por la materia y esta se clasifica en sustancias puras y mezclas en base a estos los seres vivos , objetos , etc. somos diferentes .
Los elementos están formados por átomos que están en forma liquida, solida o gaseosa.
Los átomos de un elemento o mezcla se pueden formar por medio de formulas.
Podemos observar como en la vida cotidiana tenemos el caso de mezclas heterogéneas y homogéneas, como los seres vivos , los animales al clasificarlos.
IMAGENES
Suscribirse a:
Entradas (Atom)